¿Has considerado cómo se sentirá la recuperación de la microaguja para tu tipo de piel y qué pasos específicos tomaría si tuviera piel grasa o seca?
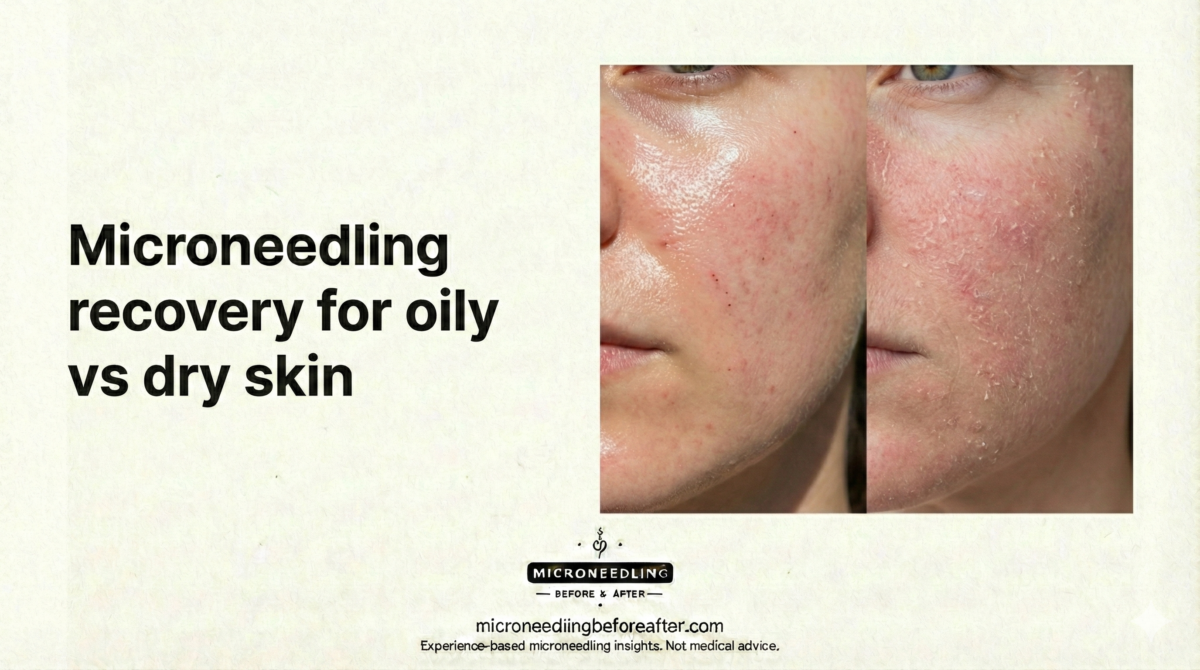
Recuperación con microagujas para piel grasa vs. piel seca
Explicaré el proceso de recuperación de la microaguja, centrándome en las diferencias entre piel grasa y seca. Me baso en principios clínicos y cuidados posteriores prácticos para ofrecer una guía clara y paso a paso que seguiría o recomendaría a mis clientes.
Qué hace la microaguja y por qué es importante la recuperación
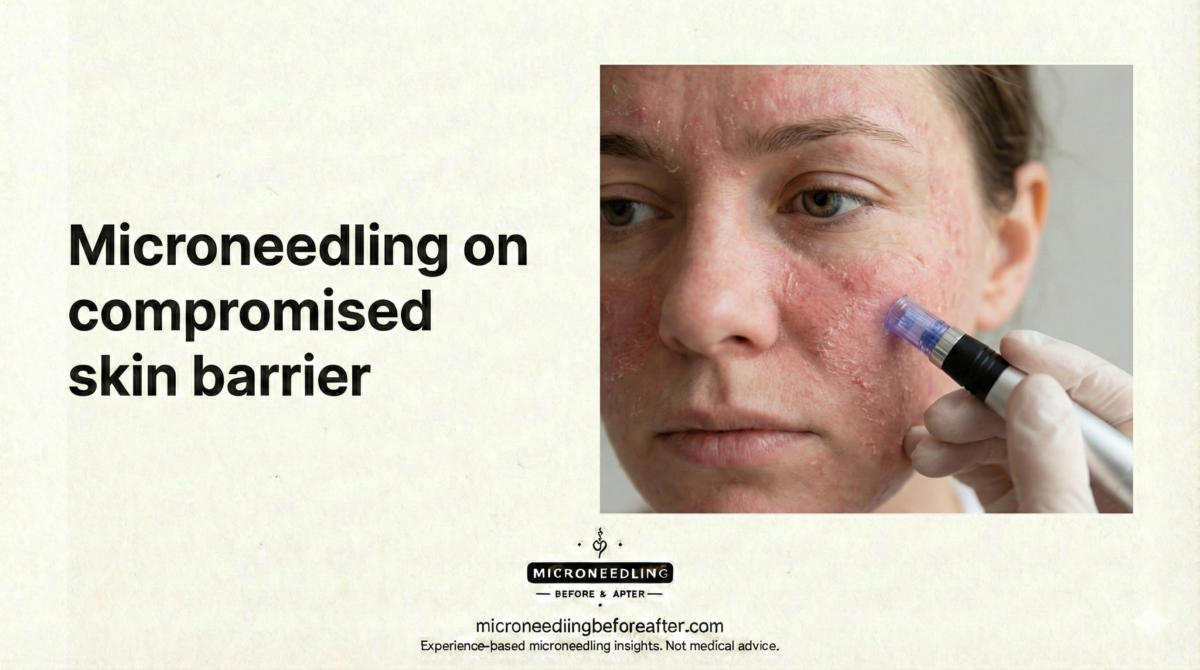
La microaguja crea microlesiones controladas en la piel para estimular la producción de colágeno y mejorar la absorción de los productos tópicos. Siempre enfatizo que la recuperación no es una simple espera pasiva, sino un período activo en el que el cuidado adecuado influye en resultados como la mejora de la textura, la remodelación de cicatrices y el control de la pigmentación. Las estrategias de recuperación deben adaptarse al tipo de piel, ya que la función de barrera, la producción de sebo y la propensión a la inflamación difieren entre la piel grasa y la seca.
Cómo el tipo de piel cambia el proceso de recuperación
Considero el tipo de piel un factor clave al planificar el cuidado posterior a la microaguja. La piel grasa suele producir más sebo y puede ser más propensa a la congestión de los poros o a brotes de acné después del procedimiento. La piel seca suele presentar una función de barrera deficiente, una mayor pérdida de agua transepidérmica (TEWL) y una tirantez y descamación más notorias después del tratamiento. Comprender estas diferencias fisiológicas me permite recomendar limpiadores, hidratantes y medidas de protección adecuados.
Diferencias fisiológicas clave entre la piel grasa y la piel seca
Quiero resumir las diferencias funcionales más importantes para que mis recomendaciones de cuidados posteriores tengan sentido.
- Producción de sebo: La piel grasa produce más sebo, lo que puede atrapar bacterias y aumentar el riesgo de inflamación después de la microaguja. La piel seca tiene baja producción de sebo y tiene dificultades para retener la humedad.
- Integridad de la barrera cutánea: La piel seca suele tener una barrera cutánea deteriorada que requiere apoyo inmediato para reducir la pérdida de agua transcutánea (TEWL) y la irritación. La piel grasa puede tener una barrera cutánea intacta, pero es propensa al acné.
- Tendencias de curación: La piel grasa puede verse menos inflamada visualmente debido al brillo graso, pero puede desarrollar comedones o pústulas. La piel seca presenta descamación, enrojecimiento y tirantez más pronunciados.
- Riesgo de pigmentación: ambos tipos pueden desarrollar hiperpigmentación postinflamatoria (HPI), pero la piel grasa y propensa al acné puede tener un riesgo ligeramente mayor si aparecen lesiones inflamatorias.
Cronograma típico de microagujas: qué esperar
Considero útil presentar una cronología general que se aplique a todos los tipos de piel y luego destacar las diferencias para la piel grasa y seca dentro de cada etapa.
Inmediato (0–24 horas)
Se espera eritema (enrojecimiento), calor y un leve sangrado localizado justo después del procedimiento. El rostro puede sentirse tirante o ligeramente hinchado. En pieles grasas, el exceso de sebo puede aparecer en cuestión de horas, mientras que en pieles secas suele sentirse incómodamente tirante.
Temprano (24–72 horas)
El enrojecimiento y la sensibilidad disminuyen gradualmente. En la piel seca, la descamación y la descamación comienzan a notarse alrededor del segundo o tercer día, a medida que la piel elimina las células microdañadas. En la piel grasa, controlo la presencia de poros obstruidos y pequeñas pústulas; la frecuencia de limpieza y el uso de productos no comedogénicos son cruciales.
Intermedio (3–7 días)
La mayor parte de la recuperación superficial visible se produce. La piel seca puede continuar descamada y sentirse tirante hasta una semana, por lo que recomiendo protocolos de reparación de la barrera cutánea. La piel grasa generalmente recupera su brillo original, pero persiste el riesgo de brotes; recomiendo una limpieza suave pero eficaz y medidas antimicrobianas si es necesario.
A largo plazo (semanas 2 a 12)
La remodelación del colágeno se produce en cuestión de semanas o meses. Superviso los resultados, como la mejora de la textura, la suavización de las cicatrices y los cambios en la pigmentación. Recomiendo usar protección solar e introducir gradualmente los ingredientes activos según el tipo de piel y su tolerancia.
Comparación de recuperación lado a lado
Utilizo esta tabla para brindar una comparación rápida y práctica de los síntomas y preocupaciones de la piel grasa frente a la piel seca durante la recuperación.
| Fase de recuperación | Piel grasa: problemas comunes | Piel seca: problemas comunes |
|---|---|---|
| 0–24 horas | Exceso de grasa, posibles poros obstruidos. | Intensa tirantez, escozor |
| 24–72 horas | Mayor riesgo de pústulas y brotes de acné superficiales. | Descamación, descamación, tirantez pronunciada |
| 3–7 días | Regrese a la oleosidad inicial; esté atento a los comedones | Descamación continua; necesita reparación de la barrera. |
| 2 a 12 semanas | Mayor riesgo de PIH si se produce inflamación | Sensible a los principios activos; riesgo de pigmentación si no se restaura la barrera. |
Preparación previa al tratamiento que recomiendo
Siempre preparo la piel para reducir complicaciones y mejorar los resultados. La preparación varía según el tipo de piel.
Recomendaciones generales previas al tratamiento
Normalmente recomiendo suspender los retinoides o exfoliantes químicos fuertes de 3 a 7 días antes, evitar la exposición solar activa y llegar con la piel limpia y sin maquillaje. Evalúo la medicación y el historial médico para descartar contraindicaciones, como el uso reciente de isotretinoína.
Consejos específicos para pieles grasas
Si hay acné activo, puedo recomendar un tratamiento tópico con peróxido de benzoilo o una rutina de cuidado cutáneo antimicrobiana a corto plazo. Les recomiendo a mis clientes que eviten usar productos nuevos, potencialmente irritantes, en las semanas previas al procedimiento.
Consejos específicos para pieles secas
Me centro en mejorar la función barrera antes de la microaguja. Suelo recomendar una hidratación intensiva con cremas hidratantes ricas en ceramidas y la suspensión temporal de agentes secantes fuertes (peróxido de benzoilo, tónicos con alcohol). También puedo recomendar un humectante suave como el ácido hialurónico antes del tratamiento.
Cuidados posteriores inmediatos (primeras 24 a 48 horas)
El cuidado posterior inmediato marca la pauta para la recuperación. Doy instrucciones claras que yo mismo seguiría.
Limpieza y protección
Limpio suavemente la piel tratada con un limpiador suave sin espuma y agua tibia. Evito frotar o usar paños abrasivos. Tanto para pieles grasas como secas, recomiendo evitar el maquillaje durante al menos 24 horas y usar solo productos aprobados por el profesional.
Refrescante y calmante
Suelo recomendar compresas frías (no hielo directamente sobre la piel) para reducir la hinchazón y el calor. Las medidas antiinflamatorias, como los sueros calmantes tópicos (centella asiática, pantenol o ácido azelaico para pieles con tendencia acneica), pueden ayudar según la tolerancia.
Aderezo y prevención de la contaminación
Insisto en que la piel tratada es esencialmente una superficie microherida. Recomiendo evitar tocarse la cara con las manos sucias, evitar saunas y baños de vapor, y evitar las piscinas durante al menos 48 a 72 horas.
Plan de recuperación día a día para piel grasa
Describo un protocolo específico que seguiría día a día para pieles grasas para reducir los brotes y favorecer la curación.
Día 0 (día del procedimiento)
- Limpie suavemente y siga la aplicación tópica inmediatamente posterior al procedimiento que indique el médico (a menudo, un suero antimicrobiano o curativo).
- Evite la aplicación de maquillaje y protector solar si el médico le recomienda esperar; de lo contrario, utilice un FPS mineral solo si está permitido.
- Utilice compresas frías para mayor comodidad.
Hago hincapié en que los aceites iniciales aparecerán y no son intrínsecamente malos, pero evito los limpiadores agresivos que los decapan.
Día 1–2
- Limpie dos veces al día con un limpiador espumoso suave con pH equilibrado para eliminar el exceso de sebo y minimizar la irritación.
- Aplique un suero hidratante ligero, no comedogénico (a base de ácido hialurónico) y una crema hidratante no comedogénica.
- Si tengo tendencia al acné, puedo usar ácido azelaico tópico, ya que tiene propiedades antiinflamatorias y antimicrobianas y, por lo general, se tolera mejor que el peróxido de benzoilo inmediatamente después de la microaguja. Consulto con mi médico antes de empezar a usar cualquier ingrediente activo.
Día 3–5
- Continúe con una limpieza suave y una hidratación ligera.
- Introduzca niacinamida tópica (hasta 5%) para ayudar a regular la producción de sebo y reducir la inflamación si se tolera.
- Mantenga la vista vigilada para detectar signos de infección o brotes pustulosos; comuníquese con mi médico si las lesiones se vuelven generalizadas o dolorosas.
Día 6–14
- Reintroduzca gradualmente los tratamientos antiacné de rutina (peróxido de benzoilo, ácido salicílico) solo después de confirmar que la barrera cutánea se está recuperando y con la guía del médico.
- Continúe con una protección solar estricta y evite las cremas oclusivas pesadas que pueden atrapar el sebo y exacerbar los comedones.
Plan de recuperación día a día para la piel seca
Ofrezco un protocolo paralelo para piel seca, centrado en restaurar la barrera y minimizar la descamación.
Día 0 (día del procedimiento)
- Utilice el ungüento o suero curativo recomendado por el médico; a menudo se sugiere un oclusivo más espeso para reducir la TEWL en piel seca.
- Evite el maquillaje durante al menos 24 horas y mantenga la piel hidratada con una crema cicatrizante según las indicaciones.
Día 1–2
- Limpie con un limpiador ultra suave y sin espuma una o dos veces al día, utilizando un contacto mínimo con el agua para reducir el escozor.
- Aplicar sueros hidratantes (ácido hialurónico de bajo peso molecular) seguidos de un humectante rico que contenga ceramidas y colesterol para reconstruir las capas lipídicas.
- Utilice un oclusivo como vaselina por la noche, si está permitido, para retener la humedad.
Día 3–5
- Es posible que se produzca descamación o peladura; utilice una exfoliación física suave solo si lo recomienda mi médico (raramente se recomienda en esta etapa temprana).
- Continúe la humectación enfocada en la reparación de la barrera con una aplicación dos veces al día.
- Evite las duchas calientes, los tónicos a base de alcohol y cualquier ingrediente secante.
Día 6–14
- Reintroduzca lentamente ingredientes activos suaves como sueros peptídicos o vitamina C de baja concentración si los tolera; evite los retinoides hasta que la piel esté completamente curada.
- Continúe con una protección solar estricta y mantenga una rutina de hidratación rica.
Ingredientes y productos recomendados
Me parece eficaz presentar los ingredientes recomendados en una tabla que contrasta lo que recomiendo para cada tipo de piel y lo que hay que evitar.
| Tipo de piel | Ingredientes que recomiendo | Ingredientes que evito en la recuperación temprana |
|---|---|---|
| Aceitoso | Ácido hialurónico, niacinamida, ácido azelaico, limpiadores poco irritantes, humectantes ligeros no comedogénicos. | Oclusivos fuertes, aceites minerales que pueden obstruir, retinoides fuertes, exfoliantes físicos. |
| Seco | Ceramidas, colesterol, ácidos grasos, ácido hialurónico, pantenol, oclusivos (petrolato) | Tónicos a base de alcohol, peróxido de benzoilo (inmediatamente después), ácidos fuertes, retinoides al principio. |
Hago hincapié en que las marcas específicas de productos son menos importantes que la tolerabilidad de los ingredientes y el etiquetado no comedogénico para pieles grasas.
Antimicrobianos y manejo del acné
Puedo incluir ácido azelaico tópico o antimicrobianos recetados para personas con acné activo. Si sospecho que hay sobrecrecimiento bacteriano o una infección importante, consulto o dermatólogo para posibles antibióticos orales u otras intervenciones.
Protección solar y prevención de la pigmentación.
Considero que la protección solar durante la recuperación es fundamental. La exposición a los rayos UV aumenta el riesgo de hipertensión inducida por el embarazo y perjudica la remodelación del colágeno.
Recomendaciones de protección solar
Recomiendo usar un FPS de amplio espectro (FPS) de 30 a 50 todos los días. Para pieles grasas, prefiero protectores solares minerales o químicos ligeros, etiquetados como no comedogénicos. Para pieles secas, elijo protectores solares con humectantes añadidos o los combino con una capa hidratante debajo del protector solar.
Control adicional de la pigmentación
Si la hiperpigmentación pilosa (PIH) es una preocupación, considero introducir agentes aclaradores tópicos como ácido tranexámico, niacinamida o hidroquinona en dosis bajas solo después de la reepitelización completa y con orientación profesional. Evito iniciar agentes blanqueadores potentes inmediatamente después de la microaguja.
Cuándo contactar a un profesional
Indico a los clientes que busquen ayuda profesional si experimentan alguno de los siguientes síntomas:
- Aumento del dolor, calor o enrojecimiento que se extiende más allá de las áreas esperadas (posible infección).
- Drenaje purulento o aumento de lesiones pustulosas.
- Hinchazón severa o signos de una reacción alérgica (urticaria, síntomas sistémicos).
- Nuevos cambios de pigmentación que se propagan rápidamente.
Subrayo que la intervención temprana previene complicaciones a largo plazo.
Manejo de complicaciones: infección, HIE y brotes de acné
Describiré cómo manejo las complicaciones más comunes y cómo la prevención difiere según el tipo de piel.
Infección
Si sospecho que hay una infección, recomiendo suspender cualquier tópico potente y contactar a un profesional de la salud. El tratamiento puede incluir antibióticos orales o tópicos, según el cultivo y el criterio clínico.
Hiperpigmentación postinflamatoria (HPI)
El manejo de la HPI incluye protección solar estricta y la posterior introducción de agentes aclaradores tópicos bajo supervisión. En el caso de la piel grasa con HPI relacionada con el acné, controlar rápidamente la inflamación reduce el riesgo de HPI.
brotes de acné
Trabajo con un profesional para equilibrar la terapia antimicrobiana y los agentes antiinflamatorios. Para la piel grasa, puede ser útil aplicar ácido azelaico tópico de forma temprana o un régimen temporal que incluya antibióticos tópicos. Para la piel seca que desarrolla acné debido a las cremas hidratantes oclusivas, modifico la rutina de cuidado de la piel a hidratantes más ligeros y no comedogénicos.
Volviendo a los ingredientes activos
Hago hincapié en un enfoque cauteloso y gradual para reintroducir principios activos fuertes.
retinoides
Normalmente espero al menos de 7 a 14 días antes de volver a aplicar los retinoides, y a menudo más tiempo para la microaguja profunda o la piel seca. Empiezo con concentraciones más bajas y las aplico cada dos noches, desarrollando gradualmente la tolerancia.
Exfoliantes químicos (AHA/BHA)
Evito los ácidos durante un mínimo de 5 a 7 días, y durante más tiempo para pieles sensibles o secas. Para pieles grasas con tendencia acneica, el ácido salicílico puede ser útil, pero debe reintroducirse lentamente y en concentraciones más bajas.
Vitamina C y otros principios activos
La vitamina C puede ser irritante; la reintroduzco después de la reepitelización y controlo el escozor. Los péptidos y los sueros con factores de crecimiento suelen ser seguros en etapas tempranas y pueden favorecer la cicatrización.
Diferencias entre la microaguja profesional y la microaguja en casa y su recuperación
Aclararé las diferencias de recuperación dependiendo de la profundidad y la configuración de la aguja.
Microagujas profesionales en el consultorio
Professional procedures typically use longer needles and create deeper microchannels, leading to more pronounced redness and a slightly longer healing phase. I follow practitioner aftercare closely and expect a stronger emphasis on avoiding contamination and strict sun protection.
At-home microneedling (derma rollers)
At-home devices use shorter needles and produce milder, more superficial effects. Recovery is generally faster and less intense, but the risk of improper sterilization and infection is higher if protocols are not followed. I recommend caution and encourage professional treatments for significant skin concerns.
Long-term maintenance and expectations
I set realistic expectations: microneedling stimulates collagen over months, and multiple sessions are often needed. I recommend a maintenance schedule and complementary treatments.
Number of sessions and intervals
I typically recommend 3–6 sessions spaced 4–6 weeks apart for collagen remodeling treatments, but individualized plans depend on skin concern, needle depth, and response. For superficial rejuvenation, fewer sessions may suffice.
Complementary treatments
I often pair microneedling with controlled topical therapies like growth-factor serums or PRP (platelet-rich plasma) under supervision. I caution against layering potent actives immediately post-procedure and recommend using supportive, hydrating serums during the healing period.
Practical lifestyle tips during recovery
I include lifestyle measures I apply myself to support optimal healing.
- Sleep: I prioritize adequate sleep to support tissue repair.
- Diet: I eat protein-rich foods and maintain sufficient hydration and micronutrients, especially vitamin C and zinc.
- Avoid smoking and excessive alcohol: Both impair wound healing and collagen production.
- Exercise: I avoid strenuous exercise that induces heavy sweating for 48–72 hours to reduce contamination risk.
Makeup and social considerations
I understand many people want to return to social activities quickly. I give practical guidance on makeup timing and camouflage options.
Makeup timeline
I usually advise avoiding makeup for at least 24 hours, but for deeper treatments waiting 48–72 hours is safer. When I reintroduce makeup, I select non-comedogenic mineral cosmetics and apply with clean tools.
Camouflage for redness
I suggest green-tinted formulations or color-correcting products only after the skin has re-epithelialized and with caution for patch testing, especially on dry skin to avoid further irritation.
Cost considerations and choosing a provider
I recommend seeking an experienced practitioner who follows sterile protocols. Lower-cost treatments may be tempting but can increase the risk of poor technique and complications. I look for providers with clear pre- and post-care instructions and a clean, professional setting.
Case examples: how I would tailor recovery plans
I present two hypothetical cases to illustrate practical differences.
Case 1: Oily, acne-prone 28-year-old
I would pre-treat active acne, consider antimicrobial stewardship, use lightweight hydrating serums and niacinamide during healing, and reintroduce salicylic acid slowly. I would monitor closely for pustules and advise rapid contact if infection is suspected.
Case 2: Dry, sensitive 45-year-old
I would strengthen the barrier before treatment, use occlusive and ceramide-rich products immediately after, avoid actives for a longer period, and reintroduce retinoids slowly over several weeks. I would manage peeling and flaking proactively.
Summary and practical checklist
I summarize the essential points and provide a concise checklist I follow.
- Pre-treatment: Stop strong actives, improve barrier for dry skin, reduce inflamed acne for oily skin.
- Immediate care: Gentle cleansing, soothing serums, avoid contamination and sun.
- First week: Oily — manage sebum with non-comedogenic hydrators; Dry — prioritize occlusion and ceramides.
- Reintroduction of actives: Gradual; longer pause for dry and for deeper procedures.
- Watch for complications: Infection, PIH, acne flares — contact a professional early.
- Maintenance: Multiple sessions may be needed; combine with sun protection and healthy lifestyle.
Checklist (printable):
| Tarea | Aceitoso | Seco |
|---|---|---|
| Pre-treatment prep | Control acne; avoid new products | Build barrier; hydrate |
| Day 0–2 | Gentle cleanser twice daily; hyaluronic acid; avoid heavy creams | Gentle cleanser; rich ceramide moisturizer; occlusive at night |
| Day 3–7 | Introduce niacinamide; monitor for pustules | Continue barrier repair; avoid actives |
| Week 2+ | Gradually reintroduce actives | Slow reintroduction of actives; use peptides first |
| Protección solar | Non-comedogenic SPF daily | Hydrating SPF daily |
Final recommendations and my closing professional note
I recommend approaching microneedling with a plan tailored to your skin type. If I had to prioritize three actions during recovery they would be: protect the skin from sun, support the barrier (especially if dry), and avoid introducing strong actives too early. I also emphasize the value of working with a qualified practitioner who provides individualized aftercare instructions. If you want, I can help draft a personalized post-procedure regimen based on your exact product preferences, medical history, and the depth of microneedling you plan to undergo.